Lipoproteins
目錄
脂蛋白的結構與分類
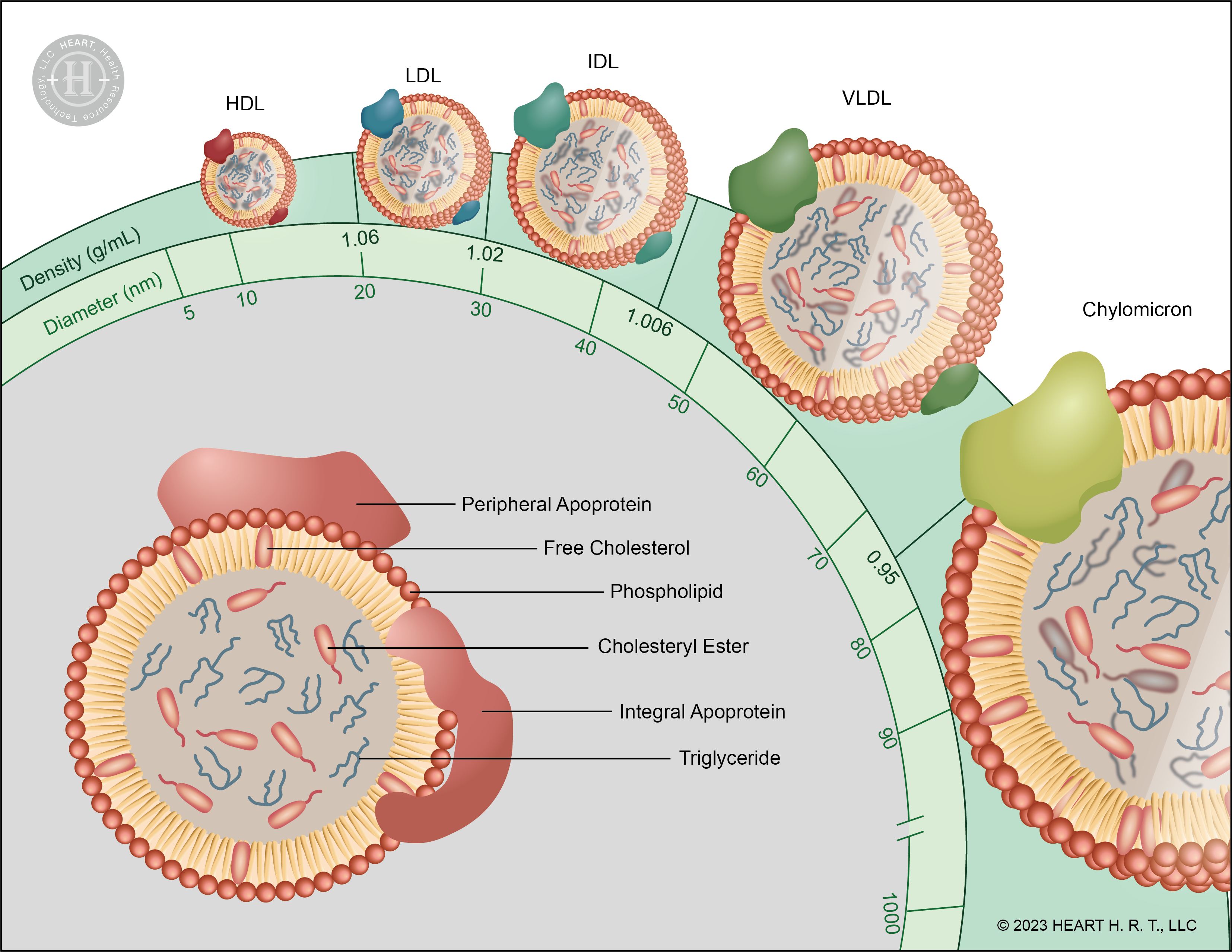
▲ 圖一、脂蛋白的結構與分類
脂蛋白 (Lipoprotein) 的結構可以分為外殼與脂質中心,外殼由磷脂 (Phospholipid) 與載脂蛋白 (Apolipoprotein, Apo) 所構成;脂質中心則包含膽固醇 (Cholesterol) 與三酸甘油酯 (Triglyceride, TG)。脂蛋白根據密度大小又可以分為乳糜微粒 (Chylomicron, CM)、極低密度脂蛋白 (Very low-density lipoprotein, VLDL)、中間低密度脂蛋白 (Intermediate-density lipoprotein, IDL)、低密度脂蛋白 (Low-density lipoprotein, LDL) 與高密度脂蛋白 (High-density lipoprotein, HDL)。
何謂低密度脂蛋白(LDL)
低密度脂蛋白負責將膽固醇由肝臟運送至體細胞及組織。與膽固醇結合後的低密度脂蛋白即「低密度脂蛋白–膽固醇 (LDL-C)」,又稱為「低密度膽固醇」。許多研究表明當血漿中 LDL-C 濃度過高時,心血管疾病風險亦隨之升高,因此 LDL-C 也常被叫作「壞的膽固醇」,是現代常用的心血管疾病風險指標[1]。但是在一些臨床案例中,即便病患體檢報告中 LDL-C 的濃度正常,還是得到了動脈粥狀硬化、心絞痛等心血管相關疾病[1][2],因此 LDL-C 可能不是用來預測心血管疾病風險的最精確標準。
降血脂藥物的機轉原理
目前醫療上針對LDL-C的降血脂藥物有很多種,其中最常見的是「Statin」與「PCSK9 抑制劑」。Statin 會抑制膽固醇在肝臟的合成;PCSK9 抑制劑則是藉由與PCSK9 結合來提升LDL-C被降解的效率。
在正常情形下,LDL-C 會與肝細胞表面的受體 (Low-density lipoprotein receptor, LDLR) 結合,然後經由胞吞作用被運送至肝臟細胞內分解。因此,LDLR 的數量與血液中 LDL-C 濃度有直接的關聯性:LDLR的數量愈多,LDL-C的濃度則愈低。而 PCSK9 (Proprotein Convertase Subtilisin/Kexin type 9) 是一種主要在肝臟合成的蛋白質,它會選擇性結合至 LDLR 上,並讓 LDL-C 與 LDLR 一同被分解。總而言之,若能夠有效抑制 PCSK9,便能使較少的 LDLR 被分解掉,提高 LDLR 的回收率,進而達到提高 LDL-C 降解效率的效果[3]。
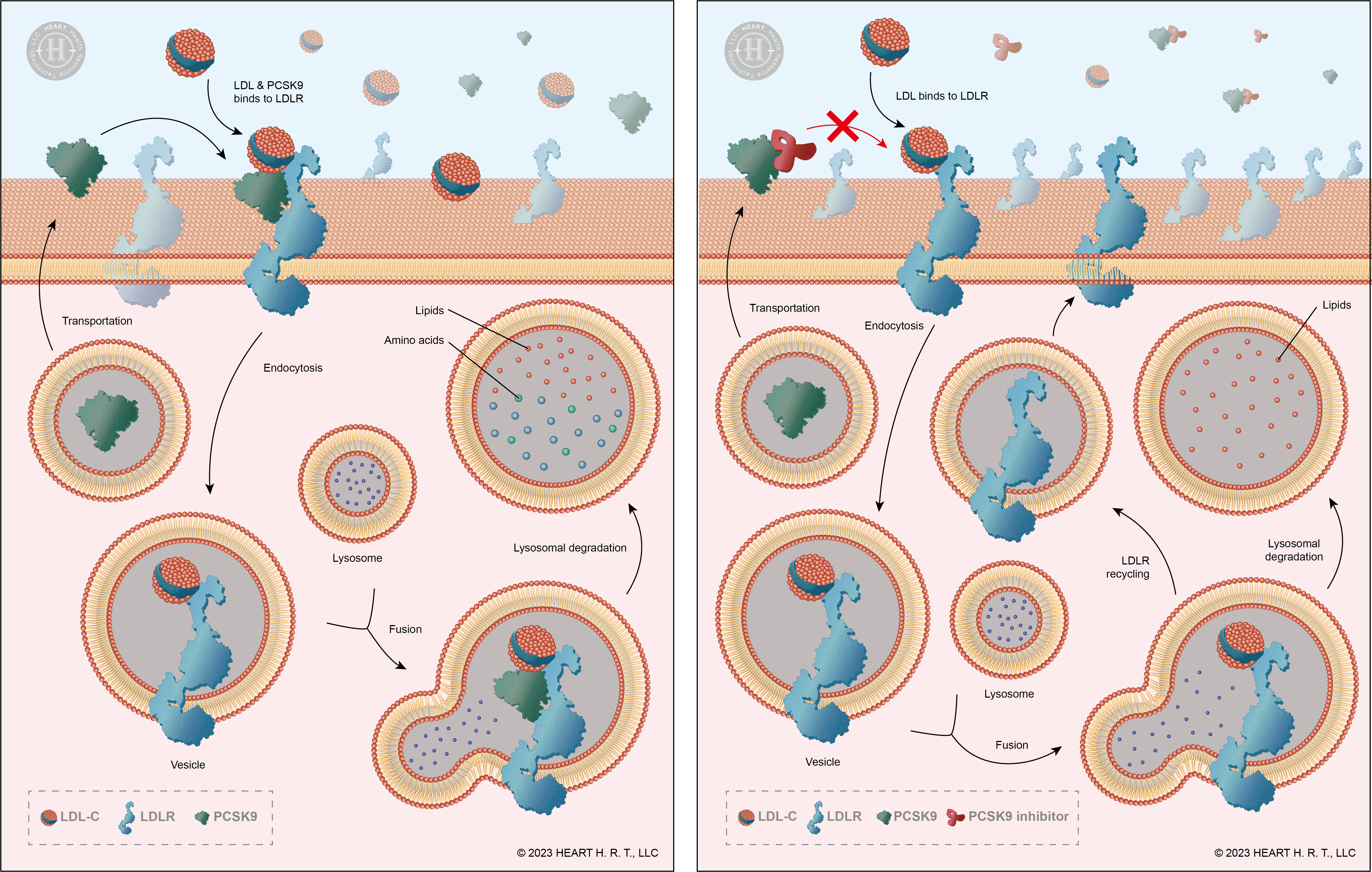
▲ 圖二、PCSK9 與其抑制劑的作用機轉
Alirocumab 與 Evolocumab 就是PCSK9 的抑制劑,臨床實驗結果表明,雖然它們可以降低 LDL-C 整體水平,並且降低心血管疾病風險,但是效果卻不如預期,在心血管疾病死亡率上也並未造成顯著差異[4][5]。這顯示 LDL-C 族群中,也許有些類型並不會與 LDLR 結合而被降解。
陰電性最高的低密度脂蛋白:L5
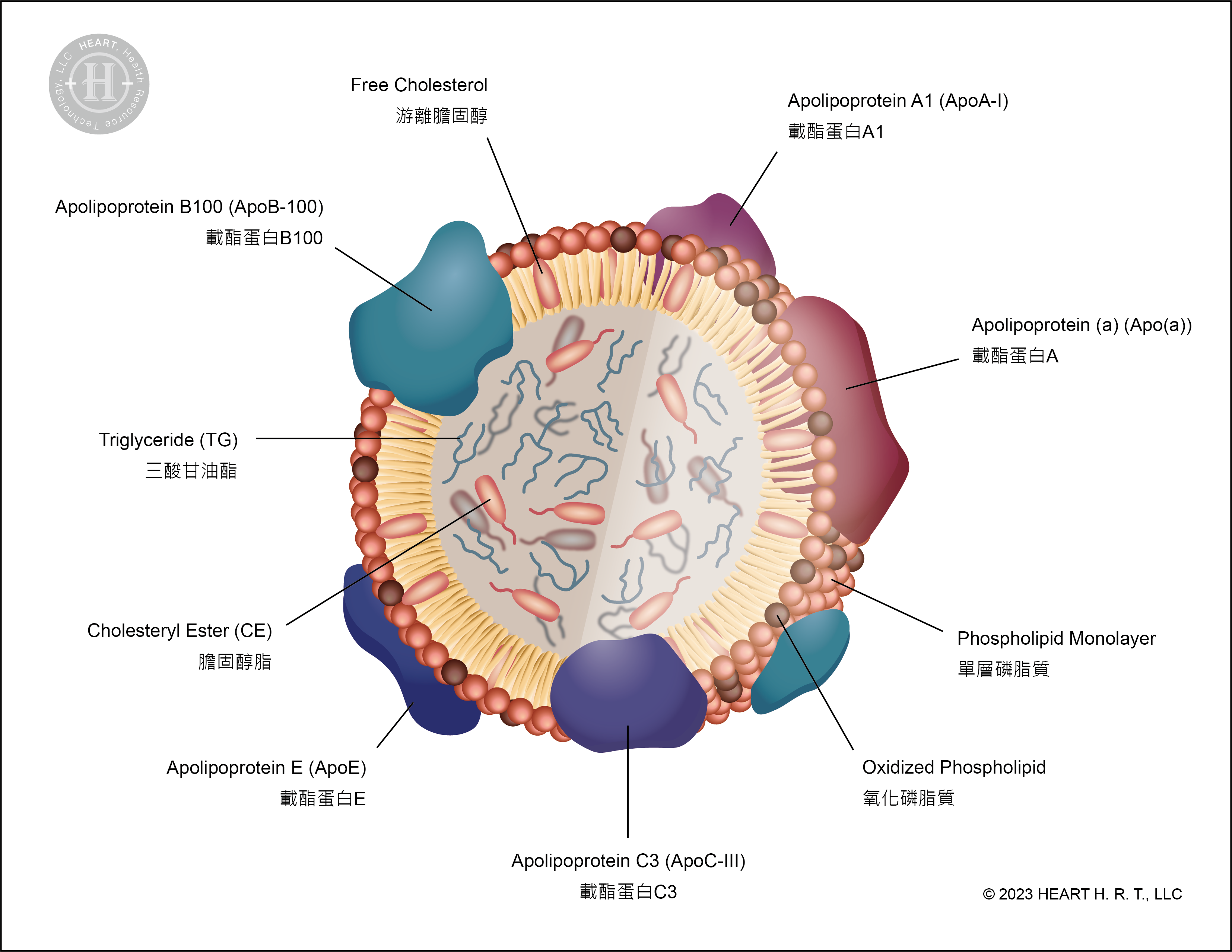
▲ 圖三、L5 的結構
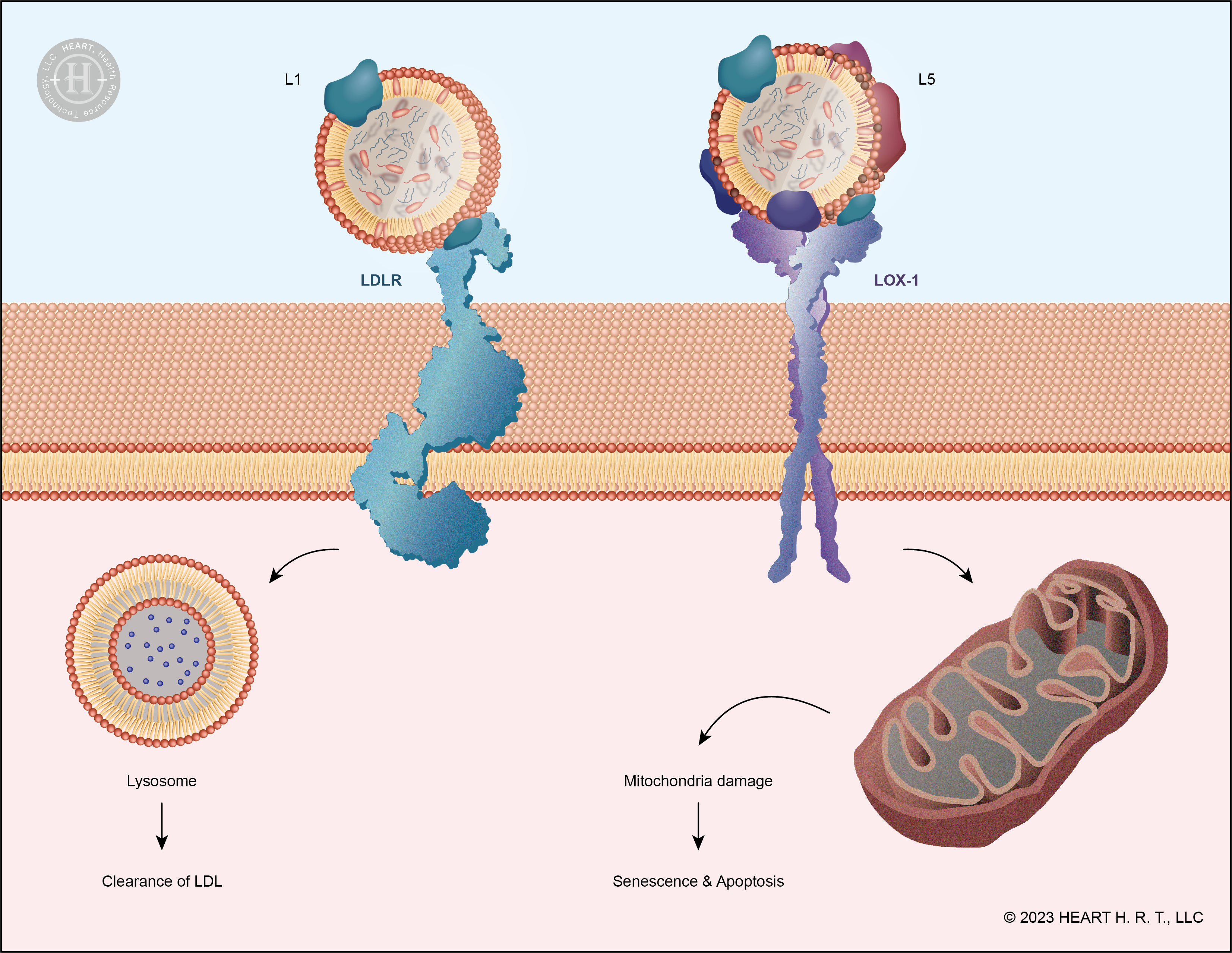
▲ 圖四、L1 與 L5 的受體分別為 LDLR 與 LOX-1
陰電性低密度脂蛋白 (Electronegative low-density lipoprotein) 的概念首次在 1979 年由任職於貝勒醫學院 (Baylor College of Medicine) 的 Gotto 教授等人提出[6],而後另一篇 1988 年的論文亦證實其存在[7]。西元 2003 年,陳珠璜教授(本公司創辦人)於期刊 Circulation 中發表了一篇論文,他根據陰電性的強弱又將 LDL 分為五個亞型:L1、L2、L3、L4 與 L5,其中 L1是正常的 LDL;L5 的陰電性最高、也最容易被氧化,也是造成動脈粥狀硬化等心血管疾病的主要原因[2][8][9]。
從結構上來看,L1 (即正常LDL)的載脂蛋白 B100 (Apolipoprotein B100, ApoB-100) 約占總比例 99.71%;而 L5 的載脂蛋白 B100 僅佔 61.26%,其餘部分由載脂蛋白 a (Apolipoprotein a, Apo(a))、載脂蛋白 A1 (Apolipoprotein A1, ApoA1)、載脂蛋白 C3 (Apolipoprotein C3, ApoCIII) 及載脂蛋白 E (Apoliprotein E) 所構成,因此也攜帶了更多的負電荷[9]。
在 L1 與 LDLR 結合的過程中,ApoB-100 上帶正電荷的 ε-胺基 (NH3+) 扮演著非常重要的角色。L1 會透過這個胺基與 LDLR 上帶負電的殘跡相互作用,而後經由胞吞作用進入細胞內被分解。而 L5 因為攜帶較多的負電荷,在構型上和 LDLR 的親和力很低,因此不會被 LDLR 所辨識[9]。與 L1 不同的是,L5 會和細胞表面的 LOX-1 (Lectin-like oxLDL receptor) 受體結合,進而啟動下游的訊息傳遞路徑,造成細胞凋亡。而過多的死細胞堆積於血管內壁,造成血管管徑縮小,便是心血管疾病的來源之一。
何謂高密度脂蛋白(HDL)
高密度脂蛋白是脂蛋白的一種,負責將血液中的膽固醇運送回肝臟。與膽固醇結合後的高密度脂蛋白即「高密度脂蛋白–膽固醇 (HDL-C)」,又稱為「高密度膽固醇」。許多流性病學的研究中顯示,HDL-C 與心血管疾病間具有顯著的負相關關聯性。因此,HDL-C 又常被稱作「好的膽固醇」,並且成為現代常見的血脂肪檢測項目,是心血管疾病的衡量指標之一。然而,近年來有愈來愈多的研究結果表明,HL-C 並非預防心血管疾病的可靠依據[10][11][12][13][14]。
膽固醇酯轉移蛋白(CETP)
膽固醇酯轉移蛋白 (Cholesteryl ester transfer protein, CETP) 是膽固醇代謝路徑中的一種蛋白質,它的功能是將 HDL 中的膽固醇脂 (Cholesteryl ester, CE) 轉移至極低密度脂蛋白 (Very low density lipoprotein, VLDL) 與 LDL,並將 VLDL 與 LDL 所攜帶的三酸甘油酯傳送至 HDL 中[10][12]。因此若能有效抑制 CETP,就能提升血液中「好的膽固醇」濃度。
科學家便以Torcetrapib[10]、Dalcetrapib[11] 與 Evacetrapib[13] 三種藥物來抑制 CETP:他們分別給予患有急性冠狀動脈綜合症,以及具有高心血管疾病風險的試驗者服用上述三種藥物。實驗結果顯示,雖然 HDL 的濃度皆得到了顯著的提升,但患者的心血管疾病風險並沒有因為 HDL 的濃度升高而降低[10][11][13]。Furtado and Sacks et al. ATVB (2022) 的實驗則發現,CETP 抑制劑 Torcetrapib 與 Evacetrapib 會增加載脂蛋白 A1 (Apolipoprotein A1, ApoA-I) 的濃度,特別是那些結構中含有載脂蛋白 C-III (Apolipoprotein C3, ApoC-III) 的 HDL 亞型,進而提高心血管疾病風險[14]。
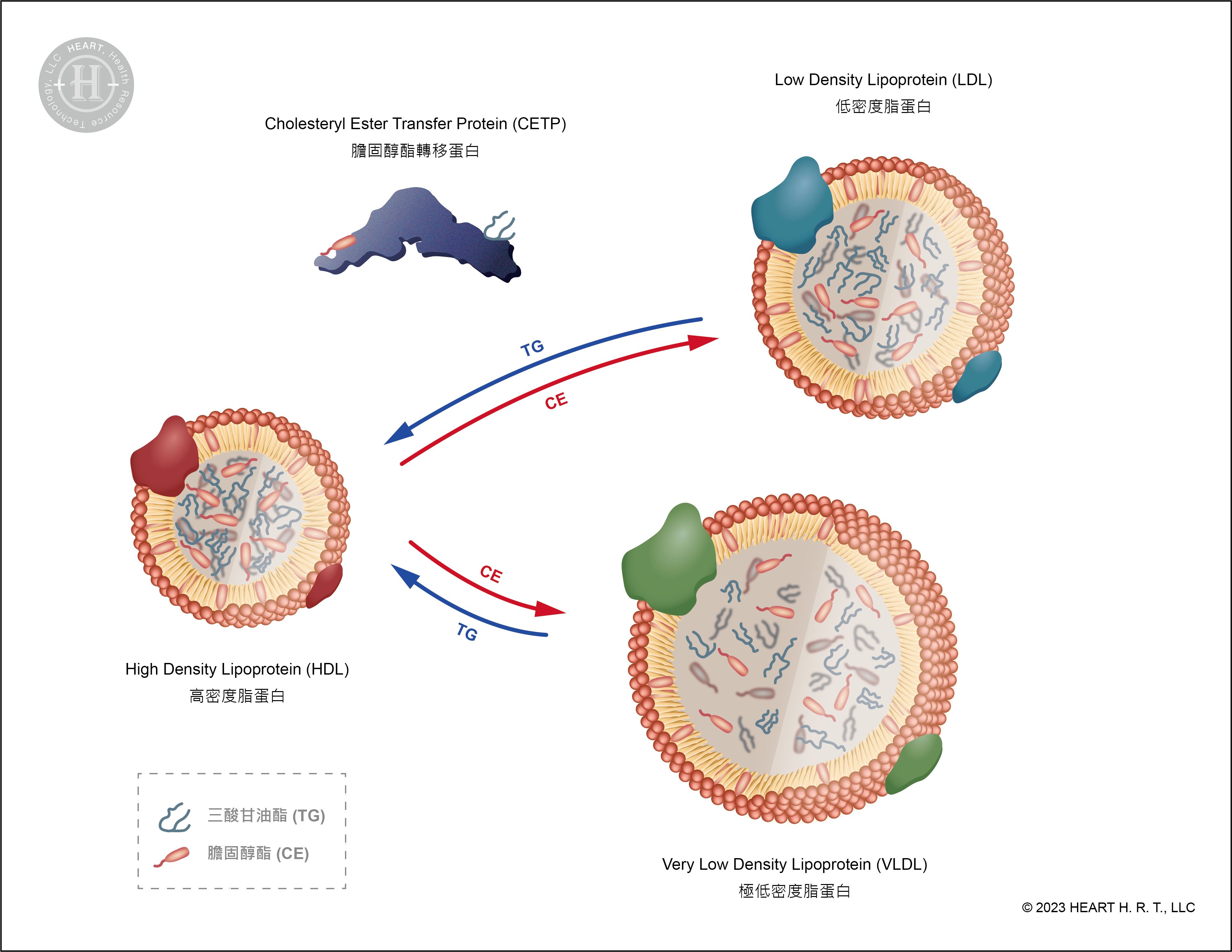
▲ 圖五、CETP 的作用機轉
陰電性最高的高密度脂蛋白:H5
HDL 可以依據所帶電荷的多寡分成五個亞型,分別是 H1~H5,其中H5是陰電性最高的亞型,而ApoC-III主要表現在 H5 之上[14][15]。另外,相關研究指出,ApoC-III 是 HDL 功能失衡的指標之一[12]。因此若能精確測量出血漿中的 H5 濃度,將會是比測量 HDL-C 更有效的心血管疾病風險評斷標準。
參考文獻
[1] Ke, L. Y., Stancel, N., Bair, H., Chen, C. H. 2014. The Underlying Chemistry of Electronegative LDL’s Atherogenicity. Curr Atheroscler Rep. 16:428.
[2] Wang, G. J., Chang, C. T., Yang, C. H., Chen, C. H. 2012. Negatively charged L5 as a naturally occurring atherogenic low-density lipoprotein. BioMedicine. 2(4):147-154.
[3] Shimada, Y. J., Cannon, C. P. PCSK9 (Proprotein convertase subtilisin/kexin type 9) inhibitors: past, present, and the future. European Heart Journal, 36(36):2415–2424.
[4] Karatasakis, A., Danek, B. A., Karacsonyi, J., Rangan, B. V., Roesle, M. K., Knickelbine, T., Miedema, M. D., Khalili, H., Ahmad, Z., Abdullah, S., Banerjee, S., Brilakis, E. S. 2017. Effect of PCSK9 Inhibitors on Clinical Outcomes in Patients With Hypercholesterolemia: A Meta‐Analysis of 35 Randomized Controlled Trials. J Am Heart Assoc. 9;6(12):e006910.
[5] Navarese, E. P., Robinson, J. G., Kowalewski, M., Kolodziejczak, M., Andreotti, F., Bliden, K., Tantry, U., Kubica, J., Raggi, P., Gurbel, P. A. 2018. Association Between Baseline LDL-C Level and Total and Cardiovascular Mortality After LDL-C Lowering: A Systematic Review and Meta-analysis. JAMA. 319(15):1566-1579.
[6] Hoff, H. F., Bradley, W. A., Heideman, C. L., Gaubatz, J. W., Karagas, M. D., Gotto Jr, A. M. 1979. Characterization of low density lipoprotein-like particle in the human aorta from grossly normal and atherosclerotic regions. Biochim Biophys Acta. 573(2):0–374.
[7] Avogaro, P., Bon, G. B., Cazzolato, G. 1988. Presence of a modified low density lipoprotein in humans. Arteriosclerosis. 8(1):79-87.
[8] Chen, C. H., Jiang, T., Yang, J. H., Jiang, W., Lu, J., Marathe, G. K., Pownall, H. J., Ballantyne, C. M., McIntyre, T. M., Henry, P. D., Yang, C. H. 2003. Low-Density Lipoprotein in Hypercholesterolemic Human Plasma Induces Vascular Endothelial Cell Apoptosis by Inhibiting Fibroblast Growth Factor 2 Transcription. Circulation. 107:2102–2108.
[9] Ke, L. Y., Engler, D. A., Lu, J., Matsunami, R. K., Chan, H. C., Wang, G. H., Yang, C. H., Chang, J. H., Chen, C.H. 2011. Chemical composition–oriented receptor selectivity of L5, a naturally occurring atherogenic low-density lipoprotein. Pure Appl Chem. 83(9):10.
[10] Barter, P. J., Caulfield, M., Eriksson, M., Grundy, S. M., Kastelein, J. J., Komajda, M., Lopez-Sendon, J., Mosca, L., Tardif, J. C., Waters, D. D., Shear, C. L., Revkin, J. H., Buhr, K. A., Fisher, M. R., Tall, A. R., Brewer, B. 2007. Effects of Torcetrapib in Patients at High Risk for Coronary Events. N Engl J Med. 22;357(21):2109-22.
[11] Schwartz, G. G., Olsson, A. G., Abt, M., Ballantyne, C. M., Barter, P. J., Brumm, J., Chaitman, B.R., Holme, I. M., Kallend, D., Leiter, L. A., Leitersdorf, E., McMurray, J. J. V., Mundl, H., Nicholls, S. J., Shah, P. K., Tardif, J. C., Wright, R. S. 2012. Effects of Dalcetrapib in Patients with a Recent Acute Coronary Syndrome. N Engl J Med. 367:2089-2099.
[12] Zheng, C., Aikawa, M. 2012. High-Density Lipoproteins: From Function to Therapy. Journal of the American College of Cardiology (JACC). 60(23): 2380-2383.
[13] Lincoff, A. M., Nicholls, S. J., Riesmeyer, J. S., Barter, P. J., Brewer, H. B., Fox, K. A. A., Gibson, C. M., Granger, C., Menon, V., Montalescot, G., Rader, D., Tall, A. R., McErlean, E., Wolski, K., Ruotolo, G., Vangerow, B., Weerakkody, G., Goodman, S. G., Conde, D., McGuire, D. K., Nicolau, J. C., Leiva-Pons, J. L., Pesant, Y., Li, W., Kandath, D., Kouz, S., Tahirkheli, N., Mason, D., Nissen, S. E. 2017. Evacetrapib and Cardiovascular Outcomes in High-Risk Vascular Disease. N Engl J Med. 18;376(20):1933-1942.
[14] Furtado, J. D., Ruotolo, G., Nicholls, S. J., Dullea, R., Carvajal-Gonzalez, S., Sacks, F. M. 2022. Pharmacological Inhibition of CETP (Cholesteryl Ester Transfer Protein) Increases HDL (HighDensity Lipoprotein) That Contains ApoC3 and Other HDL Subspecies Associated with Higher Risk of Coronary Heart Disease. Arterioscler Thromb Vasc Biol. 42:227–237.
[15] Hsieh, J. Y., Chang, C. T., Huang, M. T., Chang, C. M., Chen, C. Y., Shen, M. Y., Liao, H. Y., Wang, G. J., Chen, C. H., Chen, C. J., Yang, C. Y. 2013. Biochemical and Functional Characterization of Charge-Defined Subfractions of High-Density Lipoprotein from Normal Adults. Analytical Chemistry. 85(23):11440–11448.

